O omento maior pode ser doador de células-tronco ao miocárdio isquêmico?
Conteúdo do artigo principal
Resumo
Introdução: Recentes progressos feitos na bioengenharia de enxertos cardíacos oferecem nova modalidade terapêutica para a regeneração do tecido cardíaco pós-infarto do miocárdio. O CD34 é marcador que expressa todas as células precursoras hematopoiéticas e endoteliais, e funciona como fator de adesão celular. O anticorpo que correspondente a este marcador é utilizado na imunoistoquímica para avaliar a formação de novos vasos e a presença de células-tronco.
Objetivo: Avaliar a eficácia da omentopexia na neovascularização e células-tronco.
Métodos: Revisão colhendo informações publicadas em plataformas virtuais selecionadas (SciELO – Scientific Electronic Library Online, Google Scholar, Pubmed e Scopus). A busca iniciou-se por descritores relacionados ao tema, identificados por meio do DeCS/MESH nos seguintes descritores: “isquemia miocárdica; revascularização miocárdica; omentopexia; imunoistoquímica; CD34; células-tronco” e seus equivalentes em inglês: “stem cell; myocardial ischemia; myocardial revascularization; omentopexy; immunohistochemistry; CD34”. Foram lidos pelo título e resumo, com busca AND ou OR seguindo-se da leitura na íntegra daqueles com maior relação ao tema. Foram incluídos o total de 23 artigos.
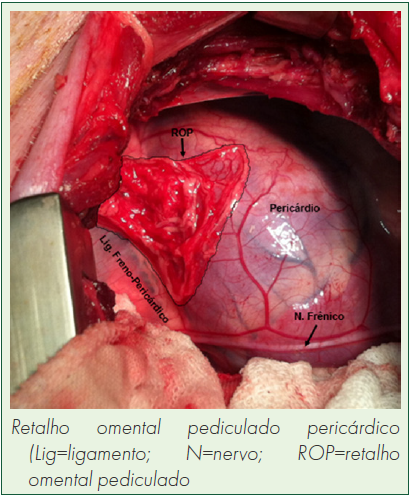
Resultados: O omento maior tem propriedade clínica marcante em conter sítios de danos teciduais. Ele aumenta seu volume tecidual em resposta às partículas estranhas e inflamatórias envolvendo diversas células imunomoduladoras com células progenitoras, em um processo chamado “ativação do omento”.
Conclusão: A cárdio-omentopexia associada à abrasão mecânica e perfurações miocárdicas, mostra ser eficiente na indução de neovascularização. O omento maior promove células-tronco - confirmadas pelo CD34 -, demonstrando grande potencial como futura terapêutica para restaurar áreas de miocárdio isquêmico.
Detalhes do artigo

Este trabalho está licenciado sob uma licença Creative Commons Attribution 4.0 International License.
Referências
Roth GA, Abate D, Abate KH, Abay SM, Abbafati C, Abassi N, et al. Global, regional, and national age-sex-specific mortality for 282 causes of death in 195 countries and territories, 1980–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2018;392(10159):1736–88. Doi: 10.1016/S0140-6736(18)32203-7
Virani SS, Alonso A, Benjamin EJ, Bittencourt MS, Callaway CW, Carson AP, et al. Heart disease and stroke statistics—2020 update: A report from the American Heart Association. Circulation. 2020;141(9):E139-E596. Doi: 10.1161/CIR.0000000000000757
Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, et al. Fourth Universal Definition of Myocardial Infarction (2018). J Am Coll Cardiol. 2018;72(18):2231–64. Doi: 10.1161/CIR.0000000000000617
Chapman AR, Adamson PD, Mills NL. Assessment and classification of patients with myocardial injury and infarction in clinical practice. Heart. 2017;103(1):10–8. Doi: 10.1136/heartjnl-2016-309530
Petriz JLF, Gomes BF de O, Rua BS, Azevedo CF, Hadlich MS, Mussi HTP, et al. Avaliação do infarto do miocárdio pela ressonância magnética cardíaca e mortalidade em longo prazo. Arq Bras Cardiol. 2014;104(2):159–68. Doi: 10.5935/abc.20140177
Kubrusly FB, Kubrusly LF, Tabushi FI, Gewehr DM, Giovanini AF, Bufon CCB, Waaga-Gasser AM, Malafaia O. Evaluation of the omentum as a stem cell donor ischemic myocardial through cd34 immunohistochemical analysis. SciELO Preprints. 2022. Doi: 10.1590/SciELOPreprints.4790
Silva KAS, Emter CA. Large Animal Models of Heart Failure: A Translational Bridge to Clinical Success. JACC: Basic to Transl Sci. 2020;5(8):840-856. Doi: 10.1016/j.jacbts.2020.04.011
Espe EKS, Aronsen JM, Eriksen M, Sejersted OM, Zhang L, Sjaastad I. Regional dysfunction after myocardial infarction in rats. Circ Cardiovasc Imaging. 2017;10(9):e005997. Doi: 10.1161/CIRCIMAGING.116.005997
Torrado J, Cain C, Mauro AG, Romeo F, Ockaili R, Chau VQ, et al. Sacubitril/Valsartan Averts Adverse Post-Infarction Ventricular Remodeling and Preserves Systolic Function in Rabbits. J Am Coll Cardiol. 2018;72(19):2342–56. Doi: 10.1016/j.jacc.2018.07.102
Reichert K, Colantuono B, McCormack I, Rodrigues F, Pavlov V, Abid MR. Murine left anterior descending (LAD) coronary artery ligation: An improved and simplified model for myocardial infarction. J Vis Exp. 2017;122: 55353. Doi: 10.3791/55353
Colbert CM, Shao J, Hollowed JJ, Ajijola OA, Fishbein GA, Duarte-Vogel SM, et al. 3D-Printed Coronary Implants Are Effective for Percutaneous Creation of Swine Models with Focal Coronary Stenosis. J Cardiovasc Transl Res. 2020 Dec 1;13(6):1033–43. Doi: 10.1007/s12265-020-10018-3
Mouton AJ, Rivera OJ, Lindsey ML. Myocardial infarction remodeling that progresses to heart failure: A signaling misunderstanding. Am J Physiol Heart Circ Physiol. 2018;315(1):71-79. Doi: 10.1152/ajpheart.00131.2018
Talman V, Ruskoaho H. Cardiac fibrosis in myocardial infarction—from repair and remodeling to regeneration. Cell Tissue Res. 2016;365(3):563–81. Doi: 10.1007/s00441-016-2431-9
Frangogiannis NG. Pathophysiology of myocardial infarction. Compr Physiol. 2015;5(4):1841–75. Doi: 10.1002/cphy.c150006
Neumann FJ, Sousa-Uva M, Ahlsson A, Alfonso F, Banning AP, Benedetto U, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40(2):87-165. Doi: 10.1093/eurheartj/ehy394
Ruel M, Falk V, Farkouh ME, Freemantle N, Gaudino MF, Glineur D, Cameron DE, et al. Myocardial revascularization trials: Beyond the printed word. Circulation. 2018;138(25):2943–51. Doi: 10.1161/CIRCULATIONAHA.118.035970
Di Nicola V. Omentum a powerful biological source in regenerative surgery. Regen Ther. 2019;11:182–91. Doi: 10.1016/j.reth.2019.07.008
Meza-Perez S, Randall TD. Immunological Functions of the Omentum. Trends Immunol. 2017;38(7):526–36. Doi: 10.1016/j.it.2017.03.002
Soucek P, Anzenbacher P, Skoumalová I, Dvorák M. Expression of Cytochrome P450 Genes in CD34+ Hematopoietic Stem and Progenitor Cells. Stem Cells. 2005;23(9):1417–22. Doi: 10.1634/stemcells.2005-0066
Tsai SH, Huang PH, Chang WC, Tsai HY, Lin CP, Leu HB, et al. Zoledronate Inhibits Ischemia-Induced Neovascularization by Impairing the Mobilization and Function of Endothelial Progenitor Cells. PLoS ONE. 2012;7(7):e41065. Doi: 10.1371/journal.pone.0041065
Krause D, Fackler MJ, Civin CI, May WS. CD34: structure, biology, and clinical utility. Blood. 1996;87(1):1–13.
Wang H, Roche CD, Gentile C. Omentum support for cardiac regeneration in ischaemic cardiomyopathy models: a systematic scoping review. Eur J Cardiothorac Surg. 2020;58(6):1118–29. Doi: 10.1093/ejcts/ezaa205
Wang J, Zhang TJ, Liu ZP, Powell L, Thorp EB, Jessen M, et al. Cardio-omentopexy Reduces Cardiac Fibrosis and Heart Failure After Experimental Pressure Overload. Ann Thorac Surg. 2019;107(5):1448–55. Doi: 10.1016/j.athoracsur.2018.11.019
Timm AR, Reiter CMA, Borini NK, Skare TL, dos Santos TAFG. Aneurisma de artéria pulmonar por doença de Behçet: síndrome de Hughes Stovin. BioSCIENCE. 2022;80(2):154-6. Doi: 10.55684/80.2.34
Voltolini G, Franck CL. Acesso venoso subclávio via fossa supraclavicular guiado por ultrassonografia: é opção segura?. BioSCIENCE. 2022;80(2):119-24. Doi: 10.55684/80.2.26